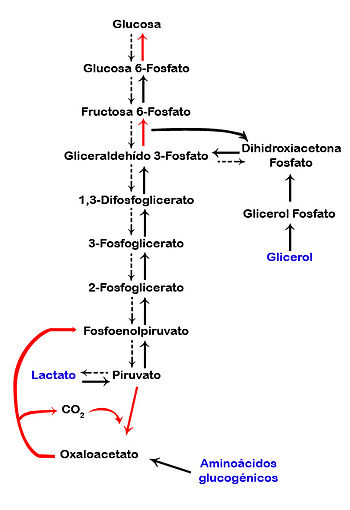
Nombres en azul indican los sustratos de la vía, flechas en rojo las
reacciones únicas de esta vía, flechas cortadas indican reacciones de la
glucolisis, que van en contra de esta vía, flechas en negrita indican la dirección de la gluconeogénesis.
reacciones únicas de esta vía, flechas cortadas indican reacciones de la
glucolisis, que van en contra de esta vía, flechas en negrita indican la dirección de la gluconeogénesis.
no es un sustrato gluconeogénico; mientras que los ácidos grasos de
cadena impar proporcionarán un esqueleto de carbonos que derivarán en
Acetil-CoA y Succinil-CoA (que sí es un sustrato gluconeogénico por ser
un intermediario del ciclo de Krebs).
Algunos tejidos, como el cerebro, los eritrocitos, el riñón, la córnea del ojo y el músculo, cuando el individuo realiza actividad extenuante, requieren de un aporte continuo de glucosa, obteniéndola a partir del glucógeno proveniente del hígado,
el cual solo puede satisfacer estas necesidades durante 10 a 18 horas
como máximo, lo que tarda en agotarse el glucógeno almacenado en el
hígado. Posteriormente comienza la formación de glucosa a partir de
sustratos diferentes al glucógeno.
La gluconeogénesis tiene lugar casi exclusivamente en el hígado
(10% en los riñones). Es un proceso clave pues permite a los organismos
superiores obtener glucosa en estados metabólicos como el ayuno.
Índice
Reacciones de la gluconeogénesis
Esquema completo de la gluconeogénesis
participan también en la gluconeogénesis; ambas rutas se diferencian
por tres reacciones irreversibles que utilizan enzimas específicas de
este proceso y los dos rodeos metabólicos de esta vía.
Estas reacciones son:
- De glucosa a glucosa-6-fosfato.
- De fructosa-6-fosfato a fructosa-1,6-bisfosfato.
- De fosfoenolpiruvato a piruvato.
Conversión del piruvato en fosfoenolpiruvato
El oxaloacetatoes intermediario en la producción del fosfoenolpiruvato en la
gluconeogénesis. La conversión de piruvato a fosfoenolpiruvato en la
gluconeogénesis se lleva a cabo en dos pasos. El primero de ellos es la
reacción de piruvato y dióxido de carbono para dar oxaloacetato. Este paso requiere energía, la cual queda disponible por hidrólisis de ATP.
La enzima que cataliza esta reacción es la piruvato carboxilasa, una enzima alostérica que se encuentra en la mitocondria. El acetil-CoA es un efector alostérico que activa la piruvato carboxilasa. Cuando hay más acetil-CoA del necesario para mantener el ciclo del ácido cítrico, el piruvato se dirige a la gluconeogénesis. El ion magnesio y la biotina son necesarios para una catálisis eficaz.
La biotina, enlazada covalentemente con la enzima, reacciona con el CO2, que se une de manera covalente. Después el CO2 se incorpora al piruvato, formando así oxaloacetato.
La conversión de oxaloacetato a fosfoenolpiruvato la cataliza la enzima fosfoenolpiruvato carboxiquinasa, que se encuentra en la mitocondria y en el citosol. Esta reacción también incluye la hidrólisis de un nucleósido-trifosfato, en este caso el GTP en vez del ATP.
Conversión de la fructosa-1,6-bisfosfato en fructosa-6-fosfato
La reacción de la fosfofructoquinasa1 de la glucólisis es esencialmente irreversible pero sólo debido a que
está impulsada por la transferencia de fosfato del ATP. La reacción que
tiene lugar en la gluconeogénesis para evitar este paso consiste en una
simple reacción hidrolítica, catalizada por la fructosa-1,6-bisfosfatasa.
La enzima con múltiples subunidades requiere la presencia de Mg2+
para su actividad y constituye uno de los principales lugares de
control que regulan la ruta global de la gluconeogénesis. La
fructosa-6-fosfato formada en esta reacción experimenta posteriormente
la isomerización a glucosa-6-fosfato por la acción de la fosfoglucoisomerasa.
Conversión de la glucosa-6-fosfato en glucosa
La glucosa-6-fosfato no puede convertirse en glucosa por la acción inversa de la hexoquinasa o la glucoquinasa;la trasferencia de fosfato desde el ATP hace a la reacción virtualmente
irreversible. Otra enzima específica de la gluconeogénesis, la glucosa-6-fosfatasa, que también requiere Mg2+, es la que entra en acción en su lugar. Esta reacción de derivación se produce también mediante una simple hidrólisis.
La glucosa-6-fosfatasa se encuentra fundamentalmente en el retículo endoplásmico
del hígado con su lugar activo sobre el lado citosólico. La importancia
de su localización en el hígado es que una función característica del
hígado es sintetizar glucosa para exportarla a los tejidos a través de
la circulación sanguínea.
Regulación
La regulación de la gluconeogénesis es crucial para muchas funcionesfisiológicas, pero sobre todo para el funcionamiento adecuado del tejido nervioso.
El flujo a través de la ruta debe aumentar o disminuir, en función del
lactato producido por los músculos, de la glucosa procedente de la
alimentación, o de otros precursores gluconeogénicos.
La gluconeogénesis está controlada en gran parte por la alimentación. Los animales que ingieren abundantes hidratos de carbono
presentan tasas bajas de gluconeogénesis, mientras que los animales en
ayunas o los que ingieren pocos hidratos de carbono presentan un flujo
elevado a través de esta ruta.
Dado que la gluconeogénesis sintetiza glucosa y la glucólisis la
cataboliza, es evidente que la gluconeogénesis y la glucólisis deben
controlarse de manera recíproca. En otras palabras, las condiciones
intracelulares que activan una ruta tienden a inhibir la otra.
Regulación por los niveles de energía
La fructosa 1,6-bisfosfatasa es inhibida por concentraciones altas de AMP,asociadas con un estado energéticamente pobre. Es decir, la elevada
concentración de AMP y reducida de ATP inhiben la gluconeogénesis
Regulación por fructosa 2,6-bisfosfato
La fructosa 1,6-bisfosfatasa es inhibida por la fructosa2,6-bisfosfato, un modulador alostérico cuya concentración viene
determinada por la concentración circulante en sangre de glucagón; la fructuosa 1,6-bisfosfatasa está presente tanto en el hígado como en los riñones.
Regulación de la fosforilación
Este proceso es dependiente de la concentración de ATP; al disminuirla concentración de ATP, la fosforilación también se observa disminuida y
viceversa. En el hígado, este proceso aumenta al aumentar la síntesis
de glucocinasa, proceso que es promovido por la insulina. La membrana de los hepatocitos
es muy permeable a la glucosa, en el músculo y el tejido adiposo la
insulina actúa sobre la membrana para hacerla permeable a ella.
Regulación alostérica
La inanición aumenta el acetil-CoA y éste estimula la piruvato carboxilasa y por lo tanto la gluconeogénesis, al mismo tiempo que inhibe la Piruvato Deshidrogenasa; la elevación de alanina y glutamina estimulan la gluconeogénesis. El cortisol aumenta la disponibilidad de sustrato y la fructosa 2,6-bisfosfato inhibe a la fructosa 1,6-bisfosfatasa.Balance energético
Hemos resaltado que las rutas catabólicas generan energía, mientrasque las anabólicas comportan un coste energético. En el caso de la
gluconeogénesis podemos calcular este coste; la síntesis de glucosa es
costosa para la célula en un sentido energético. Si partimos desde
piruvato se consumen seis grupos fosfato de energía elevada 4 ATP
(debido a las reacciones de la piruvato carboxilasa y a la de
fosfoglicerato quinasa) y 2 GTP (consecuencia de la descarboxilación del
oxalacetato), así como 2 de NADH, que es el equivalente energético de otros 5 ATP (ya que la oxidación mitocondrial de 1 NADH genera 2,5 ATP).
En cambio, si la glucólisis pudiera actuar en sentido inverso, el gasto de energía sería mucho menor: 2 NADH y 2 ATP
2 Ácido pirúvico + 4 ATP + 2 GTP + 2 NADH + 6 H2O + 2H+ -----------> Glucosa + 4ADP + 2GDP + 6Pi + 2NAD+ |
|
Importancia biomédica
La gluconeogénesis cubre las necesidades corporales de glucosa cuandono está disponible en cantidades suficientes en la alimentación. Se
requiere un suministro constante de glucosa como fuente de energía para
el sistema nervioso y los eritrocitos. Además, la glucosa es el único combustible que suministra energía al músculo esquelético en condiciones de anaerobiosis. La glucosa es precursora del azúcar de la leche (lactosa) en la glándula mamaria y se capta activamente por el bebé.
Por otro lado, los mecanismos gluconeogénicos se utilizan para depurar
los productos del metabolismo de otros tejidos desde la sangre; por
ejemplo, lactato, producido por el músculo y los eritrocitos, y glicerol, que se forma continuamente por el tejido adiposo.
Referencias
- Álvarez Rodríguez Bertha Adriana y colb. Bioquímica: Metabolismo de carbohidratos. Academia de Bioquímica. Pags: 64-70
- Benyon S., Roach J. O`Neale. Lo esencial en metabolismo y nutrición. Editorial Harcourt Brace. Madrid, España. Pags: 89-91
- Campbell Mary K., Farrell Shaw O. Bioquímica, 4a Edición. Editorial Thomson International. México D.F., 2004. Pags. 497-501
- Murray Robert K., Mayes Peter A., Granner Daryl K., Rodwell Victor W. Bioquímica de Harper, 14ª edición. Editorial Manual Moderno, México D.F., 2001, pags 233 – 244
- Mathews, Van Holde, Adhern. Bioquímica, 3ª edición. Editorial Pearson Addison Wesley. Madrid, España, 2002, Pag. 628-639



No hay comentarios:
Publicar un comentario