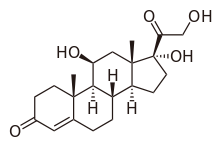
Estructura química del cortisol, principal glucocorticoide secretado por la corteza suprarrenal humana y el esteroide más abundante en la sangre periférica.
y la glucogenogénesis hepática con actividad inmunosupresora. Su acción
reguladora se extiende también al metabolismo intermedio de grasas y proteínas. Los glucocorticoides producidos principalmente en la corteza suprarrenal de los seres humanos son el cortisol, la cortisona y la corticosterona.
El cortisol es el glucocorticoide más importante en el hombre. Desde el
punto de vista farmacológico son corticosteroides para uso sistémico
cuyo fármaco de referencia es la hidrocortisona que a concentraciones altas puede suprimir la producción de hormona adrenocorticotrópica ACTH en la adenohipófisis.
Índice
- 1 Síntesis
- 2 Funciones de los glucocorticoides
- 2.1 Funciones y efectos del cortisol
- 2.1.1 Efectos del cortisol sobre el metabolismo de los hidratos de carbono
- 2.1.2 Efectos del cortisol sobre el metabolismo de las proteínas
- 2.1.3 Efectos del cortisol sobre el metabolismo de las grasas
- 2.1.4 Función del cortisol en el estrés y en la inflamación
- 2.1.5 Otros efectos del cortisol
- 2.1 Funciones y efectos del cortisol
- 3 Regulación de la secreción del cortisol
- 4 Alteraciones de la secrección corticosuprarrenal
- 5 Mecanismo de acción
- 6 Transporte, metabolismo y excreción de corticoides
- 7 Glucocorticoides sintéticos
- 8 Bibliografía
- 9 Véase también
Síntesis
La esteroidogénesis;
los glucocorticoides están en la elpise verde, a la derecha. Adviértase
que no es un grupo estrictamente definido, sino un continuo de
estructuras con creciente actividad glucocorticoide, siendo el cortisol
el ejemplo primario.
los glucocorticoides están en la elpise verde, a la derecha. Adviértase
que no es un grupo estrictamente definido, sino un continuo de
estructuras con creciente actividad glucocorticoide, siendo el cortisol
el ejemplo primario.
son secretados por las células de la capa fascicular de la corteza
suprarrenal. Como son hormonas esteroides, se sintetizan a partir del colesterol,
por medio de enzimas de la familia del citocromo P450, localizadas en
el retículo endoplásmico liso y las mitocondrias. La actividad de
algunas de estos enzimas, como la colesterol desmolasa, se incrementa
por ACTH. El ACTH (corticotropina) es liberado por la hipófisis anterior en respuesta al estrés,
y es el principal estimulador de la síntesis de glucocorticoides. El
cortisol puede sufrir la acción de la enzima 11βhidroxiesteroides
deshidrogenasa, en el hígado y otros tejidos periféricos, para dar cortisona.
Funciones de los glucocorticoides
En general, se dice que los glucocorticoides son necesarios para queel organismo resista situaciones de estrés. El término "estrés" hace
aquí referencia a una amplia gama de situaciones que tienen en común el
hecho de que favorecen la secreción de ACTH y glucocorticoides, entre
las que podríamos incluir el ayuno, la hipoglucemia, las lesiones
físicas, o la ansiedad y el miedo. Los estímulos estresantes producen la
muerte en los organismos que han sido adrenalectomizados.
Los glucocorticoides son hormonas catabólicas. Estimulan la gluconeogénesis
en hígado y riñón, de manera que elevan la glucemia. Tienen un cierto
efecto antiinsulínico en muchos tejidos periféricos, lo que colabora
también a aumentar la glucemia. Favorecen la degradación de proteínas y
aumentan por tanto la liberación de aminoácidos a la sangre, muchos de
los cuales son utilizados como sustrato de la gluconeogénesis. También
tienen un efecto lipolítico. Los glucocorticoides tienen un efecto
permisivo sobre otras hormonas, de manera que favorecen su función. En
este sentido, facilitan los efectos termogénicos y catabólicos de
catecolaminas y hormonas tiroideas. También facilitan el efecto
vasopresor de las catecolaminas. El cortisol y los demás
glucocorticoides tienen efecto sobre el sistema nervioso central. En la
hipersecreción de corticoides (síndrome de Cushing), se produce un
cierto estado de euforia, y puede llegar a producirse un trastorno
psicótico franco.
Los glucocorticoides tienen la capacidad de reducir dramáticamente las manifestaciones de la inflamación. Esto se debe a sus efectos considerables sobre la concentración, distribución y función de los leucocitos periféricos. Después de una sola dosis de un glucocorticoide de acción corta, la concentración de neutrófilos aumenta, mientras que los linfocitos, monocitos, eosinófilos y basófilos en la circulación disminuyen. La capacidad de estas células para responder a los antígenos y los mitógenos disminuye. Los cambios son máximos a las 6 horas y desaparecen en 24 horas.
Adicionalmente, los glucocorticoides disminuyen la respuesta inflamatoria que sucede por la activación de la fosfolipasa A2. Aumentan algunos fosfolípidos que reducen la síntesis de prostaglandinas y leucotrienos. También aumentan la concentración de lipocortinas que disminuyen la disponibilidad de sustratos para la fosfolipasa. Además disminuyen la expresión de la isoforma de la ciclooxigenasa 2 (COX II).
Funciones y efectos del cortisol
Efectos del cortisol sobre el metabolismo de los hidratos de carbono
• Estimulación de la gluconeogénesis: Es una de las funciones másconocidas del cortisol, estimula la formación de hidratos de carbono en
el hígado aumentando, en la mayoría de las ocasiones, la velocidad de
síntesis hasta unas seis o diez veces. Para ello el cortisol aumenta las
enzimas necesarias para convertir los aminoácidos en glucosa de las
células hepáticas; esto se debe al efecto de los glucocorticoides sobre
la transcripción de ADN en los núcleos de las células hepáticas, que lo
pasará a ARNm, y éste a su vez darán las enzimas necesarias para la
gluconeogénesis. Por otro lado, el cortisol provoca la movilización de
los aminoácidos para que se dispongan de más aminoácidos en el plasma
para entrar en la célula hepática y promover la gluconeogénesis. Todo
esto llevará a un aumento del glucógeno en las células hepáticas
• Disminución de la utilización de la glucosa: el cortisol produce
este efecto en las células de todo el organismo. Aunque se desconoce la
causa, la idea más defendida es que el cortisol retrasa directamente la
utilización de glucosa en algún punto entre la entrada de la glucosa a
la célula y el final de su degradación. Esta idea se defiende por las
observaciones en las que se comprueba que los glucocorticoides deprimen
la oxidación de NADH a NAD; dado que el NADH debe oxidarse en la
glucogenesis, este efecto provocaría la menor utilización de glucosa por
las células
• Glucemia elevada y diabetes suprarrenal: Debido a los efectos del
cortisol sobre el aumento de glucógeno y la reducción moderada en la
utilización de glucosa, el nivel de glucemia en sangre se ve elevado.
Este proceso, si supera el 50% o más del nivel de glucemia normal se
denomina diabetes suprarrenal, que tiene muchas similitudes con la
diabetes hipofisaria; Por otro lado, en la diabetes suprarrenal, la
insulina reduce moderadamente estos niveles, mientras que en la hepática
la reducción es mucho mayor y es mayor que en la hipofisaria.
Efectos del cortisol sobre el metabolismo de las proteínas
• Reducción de las proteínas celulares. El cortisol produce estosefectos en todas las células, menos en las hepáticas. Provoca una
disminución de la síntesis de proteínas y un aumento del catabolismo de
las mismas; esto se da debido a que el cortisol deprime la formación de
ARN y a una disminución del transporte de aminoácidos (sobre todo se da
en el músculo y en el tejido linfoide. Si existe mucho cortisol el
músculo puede llegar a debilitarse tanto que no sea capaz de mantenerse
de pie; y las funciones linfocitarias pueden reducirse hasta una pequeña
fracción de lo normal.
• Aumento de las proteínas hepáticas. Al disminuir las proteínas de
todo el organismo, las de las células hepáticas aumentan (también las de
las células plasmáticas producidas por el hígado. La diferencia de
producción entre las células extrahepáticas y las hepáticas, se cree que
es debido a un efecto de cortisol que favorece el transporte de
aminoácidos hacia el interior de las células hepáticas (y no a las otras
células) y de las enzimas hepáticas necesarias para la síntesis de
proteínas.
• Aumento de los aminoácidos sanguíneos, disminución del transporte
de aminoácidos a las células extrahepáticas y aumento del transporte de
células hepáticas. Se ha comprobado que el cortisol deprime el
transporte de aminoácidos al interior de las células musculares y,
quizás de otras células exrahepáticas.
La disminución del transporte de aminoácidos al interior de las
células extrahepáticas, reduce la concentración interna de aminoácidos, y
en consecuencia, disminuye la síntesis de proteínas. Sin embargo, el
catabolismo proteico de las células, continuará enviando aminoácidos (de
las proteínas ya existentes) al medio intracelular, para aumentar allí
su concentración. Por lo tanto, el cortisol moviliza los aminoácidos de
los tejidos no hepáticos, con lo que disminuirán los depósitos tisulares
de proteínas. El aumento de la concentración de aminoácidos, y que el
cortisol favorece su transporte al interior de las células hepáticas
podría explicar los efectos del hígado para producir:
a) Aumento de la tasa de desaminación de aminoácidos
b) Aumento de la síntesis de proteínas por el hígado
c) Aumento de la formación de proteínas plasmáticas
d) Aumento de la conversión de aminoácidos en glucosa (aumento de la neoglucogénesis
Por tanto, es posible que muchos efectos del cortisol sobre los
sistemas metabólicos del organismo sean consecuencia de su capacidad
para movilizar aminoácidos de los tejidos periféricos al tiempo que
aumenta las enzimas hepáticas necesarias para lograr los efectos
hepáticos
Efectos del cortisol sobre el metabolismo de las grasas
• Movilización de ácidos grasos. De una forma similar a lamovilización de aminoácidos del músculo, el cortisol va a promover la
movilización de ácidos grasos del tejido adiposo. Esta movilización dará
como resultado un aumento de la concentración de los ácidos grasos en
el plasma. Este transporte se cree que es promovido por la disminución
del transporte de glucosa a los adipocitos, que suele ocurrir en
condiciones extremas (como la falta de alimentación),donde será
necesaria otra fuente de energía (los ácidos grasos). Se trata de un
mecanismo lento, que requiere de varias horas.
• Obesidad causada por el cortisol. Aquellas personas que presenten
una secreción de cortisol excesiva, presentarán una obesidad
caracterizada por un deposito excesivo de grasa en el tórax, y en las
regiones craneales. Se cree que se produce como consecuencia de una
sobrealimentación
Función del cortisol en el estrés y en la inflamación
Los traumatismos, infecciones, calor o frío intenso, inyecciones denoradrenalina, cirugías, inyecciones subcutáneas de necrotizantes y
cualquier enfermedad debilitante provocan un aumento de la liberación de
cortisol. Se cree que este aumento puede ser beneficioso porque
movilizan rápidamente las grasas y aminoácidos(esto facilita la
producción de energía y la formación de sustancias como la
glucosa,purinas o pirimidinas).
• Efectos antiinflamatorios del cortisol
La principal función del cortisol es la de bloquear la inflamación
causada por cualquier tipo de daño, e incluso anularla antes de que
ocurra (véase el proceso de inflamación) La inflamación es inhibida por
parte del cortisol, en las primeras etapas (donde se libera gran
cantidad de sustancias que activan el proceso inflamatorio y aumenta el
flujo sanguíneo y la salida de plasma en la zona dañada)o incluso antes,
y si ha comenzado, la finaliza rápidamente. Uno de los efectos
antiinflamatorios más importantes que provoca el cortisol, es la estabilización de las membranas de los lisosomas;
hace más resistentes a estas membranas, evitando así que se libere el
contenido enzimático que contienen y que aumenta la inflamación. Otro de
los efectos, es la impermeabilidad de los vasos; los hace menos
permeables para que se libere menos plasma. Un tercer efecto, es que
disminuye la formación de prostaglandinas y leucotrienos, lo que provoca
una reducción de la movilización de leucocitos y de la fagocitosis en
la zona afectada Además, reduce la producción de linfocitos T porque
inhibe el sistema inmunitario (esto reduce las reacciones que se
producen en el tejido y que aumentarían la inflamación). Y por último,
reduce la temperatura (evita la fiebre) debido a que reduce los niveles
de interleuquina-I, y como consecuencia también se reduce la
vasodilatación.
Incluso cuando la inflamación ha madurado, la administración de
cortisol provoca una reducción de los efectos en poco tiempo(quizás como
consecuencia de la movilización de aminoácidos para reparar los
tejidos, por el aumento en la producción de glucosa, o por la
movilización de grasas para aporte energético).
Por todo lo mencionado, la administración de cortisol, es importante
en el tratamiento de enfermedades como la artritis reumatoide, la fiebre
reumática o la glomerulo nefritis. El cortisol no corrige el proceso
básico de la inflamación, pero evita los efectos nocivos de su
respuesta.
Otros efectos del cortisol
Aunque el cortisol es predominantemente un glucocorticoide, tiene unefecto mineralocorticoideo cuando existe en altas concentraciones.
Contribuye a la mantención del volumen extracelular y provoca leve
retención de sal y agua. Además sensibiliza a las arteriolas a la acción
de vasoconstricciones como adrenalina; las últimas condiciones
promueven la aparición de hipertensión arterial cuando existe exceso de
glucocorticoides
Sobre la alergia
Bloquea la respuesta inflamatoria de las alergias. Dado que larespuesta inflamatoria suele ser la responsable de muchos de los efectos
de las alergias, la administración de cortisol palía estos efectos. Por
ejemplo el cortisol puede llegar a evitar la muerte en un choque
anafiláctico.
Sobre las células sanguíneas y la inmunidad en las enfermedades infecciosas
La administración de cortisol, o un aumento excesivo de éste por laglándula suprarrenal provoca una gran reducción de eosinófilos y
linfocitos en la sangre. Además puede llegar a producir la atrofia del
sistema inmunitario, y por tanto de células T y anticuerpos; en
consecuencia, el individuo que lo sufra tendrá una mayor disposición a
adquirir enfermedades infecciosas o incluso letales, debido a la
reducción de la eficacia de su sistema inmune. Aunque por otro lado,
esta reducción del sistema inmunitario, facilita que no se produzcan
rechazos de trasplantes. Los glucocorticoides estimulan la
eritropoyesis, dando lugar a un aumento en el número de hematíes,
llamado poliglobulia.
Acción permisiva
Para que varias reacciones metabolicas ocurran deben estar presentespequeñas cantidades de glucocorticoides, aunque ellos no sean los que
producen las reacciones en si. Los efectos permisivos incluyen la
necesidad de glucocorticoides para que el glucagon y las catecolaminas
ejerzan su acción calórica, para que las catecolaminas alcancen sus
efectos lipolíticos y para que produzcan la respuesta presora y
broncodilatadora. Reactividad vascular: En animales con insuficiencia
suprarrenal el musculo liso vascular pierde su capacidad de respuesta a
la adrenalina y noradrenalina.los capilares se dilatan y finalmente se
vuelven permeables a los pigmentos coloides.Es probable que la falta de
respuesta a la noradrenalina liberada en las terminaciones nerviosas
norardrenergicas afecte a la compensación vascular a la hipovolemiande
la insuficiencia suprarrenal y promueve el colapso cardiovascular.los
glucocorticoides restauran la capacidad de respuesta vascular.
Efecto sobre el sistema nervioso
En caso de insuficiencia suprarrenal,se dan cambios en le sistemanervioso que se revierten solo con glucocorticoides, incluyen la
aparición de ondas electroencefalográficas más lentas del ritmo normal y
cambios en la personalidad de tipo ligero como irritabilidad,
aprehensiones e incapacidad para concentrarse.
Efectos sobre el metabolismo del agua
La insuficiencia suprarrenal se caracteriza por la incapacidad desecretar una carga de agua, la carga al final se excreta pero es tan
lenta que existe el peligro de intoxicación por agua. Solo los
glucocorticoides reparan este defecto. En pacientes con insuficiencia y
que no reciben glucocorticoides la glucosa puede causar fiebres altas
(“fiebre por glucosa”) seguida de colapso y muerte.Se supone que la
glucosa se metaboliza, el agua diluye el plasma y el gradiente osmótico
resultante entre el plasma y las células determina que las células del
centro termorregulador del hipotálamo se hinchen tanto que se interrumpa
su función. Se desconocen las causas de esta anomalía. Las
concentraciones plasmáticas de vasopresina se elevan en la insuficiencia
suprarrenal y disminuyen con le tratamiento de glucocorticoides.El
índice de filtración glomerular es bajo y tal vez ello contribuya a la
deficiencia en la excreción de agua.El efecto selectivo de los
glucocorticoides en la excreción anormal de agua es consistente con esta
posibilidad porque ,aunque los mineralocorticoides mejoren la
filtración mediante la restauración del volumen plasmático,los
glucocorticoides elevan el índice del filtración glomerular en mucha
mayor medida.
Efectos del cortisol en el embarazo
-Metabolismo materno del cortisol
El metabolismo del cortisol se altera considerablemente durante elembarazo, en el cual aumenta de modo progresivo su nivel en el plasma
materno. El ritmo circadiano normal de secreción de cortisol persiste,
si bien los niveles plasmáticos de la hormona correspondientes a las
últimas horas de la tarde y las primeras de la noche no presentan una
disminución tan acusada como la que se observa en mujeres no embarazadas
o después del tratamiento con estrógenos. El nivel de transcortina en
plasma también aumenta progresivamente, desde unos 3.5 mg% hasta un pico
en el tercer trimestre, de 7-10mg%. Los niveles elevados de
trasncortina durante la gestación se deben probablemente a los valores
aumentados de estrógenos en sangre, y es probable que la sustancia
activa sea el estradiol-17β, ya que el estriol no tienen influencia
sobre el nivel de transcortina. La progesterona no influye en el nivel
plasmático de transcortina. En el curso de la gestación, la excreción
urinaria de metabolitos del cortisol no se modifica o aumenta sólo
levemente. Existe una disminución de la excreción en la orina de los
metabolitos 5α reducidos del cortisol y de la corticosterona. Estudios
recientes demuestran que en la mitad y en la parte final del embarazo
los 17-hidroxiesteroides urinarios y el índice de secreción de cortisol
están disminuidos. Por tanto, la concentración plasmática aumentada de
cortisol no es consecuencia de un aumento de la secreción de la hormona.
La excreción urinaria de cortisol libre o no conjugado está aumentada
durante el embarazo, siendo los valores de 10-80 µg/día en la mujer no
embarazada y de 90-140 μg/día durante la gestación. Estos datos
corroboran que hay un pequeño aumento del cortisol libre del plasma,
puesto que su excreción está en función de la concentración global de
cortisol plasmático no ligado. Aunque las mujeres embarazadas no
manifiesten signos ni síntomas evidentes del hipercortisolemia (síndrome
de Cushing), hoy existe coincidencia en que los niveles plasmáticos de
cortisol libre o no ligado aumentan durante el embarazo. Dado que el
embarazo no se acompaña de modificaciones del índice de secreción de
cortisol, es muy probable que exista un reajuste del punto fijo en la
retroacción negativa entre el cortisol no ligado y la ACTH.
-Metabolismo fetal del cortisol
La corteza suprarrenal del feto humano es diferente a la del adulto.En el feto, la porción de la glándula que en el adulto se convertirá en
la zona glomerular, zona fasciculada y zona reticular constituye sólo
una pequeña parte de la corteza. La hipófisis fetal humana produce la
mayoría, si no todas, las hormonas peptídicas de la glándula adulta,
incluida la ACTH. Las suprarrenales de los fetos anencefálicos se
desarrollan normalmente durante las primeras 20 semanas de gestación,
pero a continuación la zona fetal involuciona. Por lo tanto, en el
desarrollo temprano el crecimiento de la suprarrenal fetal puede estar
mantenido por HCG placentaria (gonadotropina coriónica humana) o por una
adrenocorticotropina placentaria. La corteza suprarrenal del feto es
capaz de sintetizar un gran número de esteroides, principalmente
mediante la transformación de la pregnenolona y de la progesterona
procedentes de la placenta. La zona fetal de la corteza suprarrenal
fetal, que ocupa cerca del 80% de la glándula, se desarrolla durante la
segunda mitad del embarazo bajo la influencia de la ACTH hipofisiaria
del feto, y posiblemente de las gonadotropinas coriónica y de la
hipófisis fetal, y quizá de la prolactina, cuya secreción guarda
estrecha relación con las fases de crecimiento de la suprarrenal fetal.
Cuando se encuentra con las grandes cantidades de pregnenolona
placentaria, la suprarrenal fetal forma principalmente
deshidroisoandrosterona (pregnenolona, 17α-hidroxipregnenolona,
deshidroisoandrosterona, sulfato de deshidroisoandrosterona). La
concentración de cortisol en el plasma materno es unas 4 veces superior
al nivel plasmático fetal. Esta baja concentración de cortisol en el
feto puede deberse en parte a la baja concentración de transcortina
plasmática, que en la madre es de 8-9 mg% y en el fetal de 1.5-2.0 mg%.
Las afinidades de unión del cortisol para la transcortina fetal y
materna son las mismas.
Cortisol en el parto
Recientemente se ha supuesto que el trabajo de parto se inicia pormedio de una señal que proviene del feto, y que esta señal bioquímica
consiste en un aumento de la secreción suprarrenal fetal de cortisol. En
el ser humano, cuando se produce un parto espontáneo los niveles
séricos de cortisol en el cordón aumentan 2-4 veces si la salida del
feto es vaginal o a través de una cesárea. Sin embargo, los niveles no
se modifican si el parto es inducido. Los niveles de cortisona en el
suero del cordón umbilical aumentan si el parto es espontáneo o
inducido, lo que hace pensar que el cortisol sérico del cordón refleja
la secreción adrenocortical fetal, mientras que el aumento en el nivel
de cortisona es secundario a la transferencia de cortisol materno a
través de la placenta. El cortisol en el líquido amniótico muestra una
buena correlación con el presente en el plasma del cordón, pero no con
el del plasma materno. Durante el embarazo se produce un aumento del
cortisol en el líquido amniótico, entre la semana 10-15 (0.5 μg %), y
otro entre la semana 35-37 (1 μg %), seguidos de una elevación brusca en
las últimas una o dos semanas antes del comienzo del trabajo de parto
(2-3 μg %). Esto indica que, poco antes del comienzo del parto
espontáneo se produce un aumento del cortisol fetal con independencia
del nivel materno. Algunos investigadores han sugerido que el aumento
del cortisol fetal que se aprecia durante el parto es consecuencia del
estrés producido por el parto. No obstante, los bajos niveles de
cortisol en niños nacidos de un parto inducido demuestran que los
valores altos de esta hormona durante la parturición no son meramente
secundarios al trabajo de parto. En recién nacidos afectados del
síndrome de sufrimiento respiratorio se han encontrado niveles
plasmáticos de cortisol bajos, habiéndose señalado que la administración
de glucocorticosteroides a las madres puede evitar dicho síndrome en
los niños prematuros.
Cortisol en el ejercicio
El entrenamiento de la resistencia es un gran generador de cortisolsi este es mayor a 40 minutos y de una moderada intensidad. Algunos
estudios han mostrado que la ruptura de proteínas puede llegar de un 5% a
un 20%. Aún elevaciones suaves en el cortisol sérico, pueden aumentar
la concentración de glucosa plasmática y el catabolismo proteico en
pocas horas en individuos sanos. Inhibe los niveles de la hormona del
crecimiento (GH), estimulando la liberación de somatostatina (el
antagonista de la GH). Se comprobó también que reduce la expresión de
IGF-I, el factor anabólico por excelencia relacionado con la insulina.
IGF-I se sintetiza en el hígado a partir de la GH Responsable de la
mayoría de los efectos positivos de la GH . Inhibe a la gonadotrofina y a
la hormona estimuladora de la tiroides (TSH). Es por esto que los
esteroides sexuales y factores de crecimiento, se vuelven resistentes a
dichas sustancias. Suprime la acción de una enzima llamada 5'
deiodinasa, que es la que activa la hormona tiroidea T4 parcialmente
activa, en T3 (totalmente activa). Con una consecuencia interesante:
disminuir la tasa metabólica, y hacer más difícil la pérdida de grasa
corporal. Aparte de distribuirla preferentemente en la zona
periabdominal. En individuos sobreentrenados (definido como un
incremento en el volumen y/o intensidad del entrenamiento que conduce a
una disminución del rendimiento) los niveles de cortisol aumentan,
mientras que los de testosterona disminuyen. Para medir el
sobreentrenamiento se usa un cociente: testosterona:cortisol. Si su
relación es mayor a 1 significa que el atleta está anabolizando y si es
menor, que esta sobreentrenado, es decir que está desentrenándose. Los
niveles aumentados de cortisol ejercen un efecto adverso en los niveles
de testosterona. De hecho, uno de los principales efectos
anti-catabólicos de la testosterona y de los anabólicos esteroides, es
la disminución del metabolismo del cortisol muscular. Esta es una de la
razones por las cuales muchos atletas pueden sobreentrenar cuando toman
anabólicos esteroides, y aun así incrementar su masa corporal magra y su
fuerza. Algunas investigaciones indican que la respuesta al cortisol en
el entrenamiento de la resistencia se normaliza luego de cerca de cinco
semanas, y la relación testosterona:cortisol no se ve afectada
adversamente luego de largos períodos de entrenamiento. Esto sugiere una
capacidad adaptativa del cuerpo. La depresión como signo del
sobreentrenamiento también tiene su origen en el exceso del cortisol. Un
estudio llevado a cabo para determinar el efecto de distintas
intensidades de ejercicio (44.5 +/- 5.5%, 62.3 +/- 3.8%, y 76.0 +/- 6.0%
del VO2máx) sobre los niveles de cortisol salival, ha demostrado que el
ejercicio menor a 40 minutos de duración no produce diferencias
significativas cualquiera sea la intensidad. Sólo durante el ejercicio
de más alta intensidad, el cortisol fue significativamente más alto a
los 59 minutos de ejercicio. Estos datos sugieren que sólo el ejercicio
de alta intensidad y larga duración produce elevaciones significativas
de cortisol salival. Un estudio realizado con distintos volúmenes de
ejercicio (alto, moderado y bajo), muestra que los niveles de cortisol
tienden a ser más altos luego del mayor volumen, pero las diferencias no
son significativas. Sin embargo, los niveles de cortisol vuelven más
rápido a los valores basales, cuando el volumen es bajo o moderado,
mientras que permanecen altos luego de un gran volumen de ejercicio de
resistencia. El cortisol en exceso puede conducir también a la
hipertensión, por causa de retención de sodio y excreción de potasio,
sin embargo, es necesario por sus efectos antiinflamatorios, por lo que
deben existir ciertos niveles que aseguren su función.
Regulación de la secreción del cortisol
• Control de la secreción de cortisol por la ACTH (homona adrenocorticotropa de la hipófisis)La secreción de cortisol está controlada casi en su totalidad por la
ACTH,un polipepido de treinta y nueve aminoácidos secretado por la
hipófisis anterior ( también llamada corticotropina o
adrenocorticotropina)
• Control de la secreción de ACTH por el hipotálamo
En el hipotálamo existe el llamado factor liberador de corticotropina
(CRF= corticotropin releasing factor), que es secretado en la zona
media del hipotálamo (concretamene, en el plexo capilar del sistema
portal hipofisario) y luego trasladado a la hipófisis anterior donde
induce la secreción de ACTH. El CRF es un polipéptido de 41 aminoácidos,
secretado por los cuerpos celulares de las neuronas que se encuentran
en el núcleo paraventricular del hipotálamo. Sin CRF, existirían mínimas
cantidades de ACTH
• Mecanismo por el que la ACTH activa las células de la corteza suprarenal para producir esteroides
El principal efecto de la ACTH es la activación de la adenilciclasa
de la membrana de las células de la corteza suprarrenal; como
consecuencia se induce la formación de AMP cíclico que actuará como
segundo mensajero. El aumento de AMP cíclico activa enzimas
intrecelulares que formarán las hormonas corticosuprarrenales. Una de
esas enzimas es la proteín quinasa A, que es la encargada de convertir
colesterol en pregnenolona; este paso es "limitante" para la formación
de hormonas coricosuprarrenales, por eso es muy importante la
estimulación con ACTH para la formación de cualquier hormona
suprarrenal. Por otro lado, la activación continua por parte de ACTH en
la corteza suprarrenal, pueden provocar además de un aumento de la
actividad secretora, la hipertrofia y proliferación de las células de la
corteza suprarrenal(sobre todo donde se secreta cortisol y andrógenos)
Efecto del estrés fisiológico sobre la secreción de ACTH y sobre la secreción corticosuprarrenal
Cualquier tipo de estrés puede dar lugar a un aumento de lasecrección de ACTH, y en consecuencia también de cortisol. Los estímulos
dolorosos causados por lesiones tisulares o de estrés físico son
transmitidos por el tronco encefálico hacia el hipotálamo, donde se
secreta el CRF; y en pocos segundos hay cortisol en sangre. Por otro
lado, se cree que el sistema límbico aumenta su actividad como
consecuencia de un estrés mental, sobre todo en amígdalas e hipocampo; y
es desde el hipocampo, desde donde se emiten las señales hacia el
hipotálamo.
• Efecto inhibidor del cortisol sobre el hipotálamo y la hipófisis anterior para disminuir la secreción de ACTH.
El cortisol produce retroalimentación negativa sobre el hipotálamo y
la hipófisis anterior. Es decir,cuando hay altos niveles de cortisol,la
secreción de ACTH se inhibe hasta que se alcancen niveles normales de
cortisol.
Resumen del sistema control
Ya mencionamos que el estrés es un punto de regulación de lasecreción, y además existe una retroalimentación negativa por parte del
cortisol en el hipotálamo y en la hipófisis anterior. No obstante, los
efectos del estrés van a ser los más importantes para la regulación de
la secreción del cortisol. Sin embargo, también existen otros factores.
• Ritmo circadiano de la secrección de glucocorticoides
Los niveles de CRF, ATCH y cortisol son elevados en las primeras
horas de la mañana, pero bajan a úlima hora de la tarde. Esto ocurre
debido a la alteración cíclica de 24 horas de las señales procedentes
del hipotálamo. Por lo tanto, las determinaciones de cortisol tienen
valor cuando se expresan indicando el momento del ciclo en que se
realizaron. Un individuo con alteraciones del sueño, también alterará
los ciclos circadianos de cortisol.
Secreción de hormona estimulante de los melanocitos, de lipotropina y de endorfina en asociación con ACTH
Antes de la secreción de ACTH como tal, se secreta una prehormona másgrande que el ACTH, y que contiene como una de sus subunidades, el
ACTH. También tiene como subunidades la hormona estimulante de
melanocitos (MSH), la β-lipotropina
y la betaendorfina. Ninguna de estas hormonas tiene un efecto
importante, excepto si los niveles de ACTH aumentan; en este caso,
pueden darse enfermedades como la enfermedad de Addison. La MSH, es la
responsable de la formación de melanina por parte de los melanocitos
presentes en la dermis y en la epidermis. Esta hormona tiene niveles
especialmente altos en algunos animales inferiores, que presentan un
"lobulo" intermedio entre los lóbulos hipofisarios anterior y posterior,
llamado pars intermedia. En este caso, la MSH, está controlada
en respuesta a la luz que recibe el animal o en respuesta a otros
factores ambientales, pero independientemente del hipotálamo. Por
ejemplo, algunos animales árticos tienen pelo oscuro en verano y blanco
en invierno. La ACTH, debido a su semejanza con MSH (provienen de la
misma prehormona), tiene un efecto estimulador sobre los melanocitos.
Además, debido a que las secrecciones de MSH son bajas, es probable que
la mayor parte de la secreción de melanina por parte de los melanocitos
sea debida a ACTH ya que se secreta en mayores cantidades.
Alteraciones de la secrección corticosuprarrenal
Enfermedad de Addison
Esta enfermedad se debe a la secreción insuficiente deglucocorticoides y mineralocorticoides, con hipoglucemia, alteraciones
del equilibrio del sodio y del potasio, deshidratación , hipotensión,
pérdida rápida de peso corporal y debilidad generalizada.
La secreción insuficiente de glucocorticoides causa que se dificulte
mantener la glucemia normal entre las comidas, porque no puede
sintetizar cantidades importantes de glucosa por gluconeogenia. La
ausencia de cortisol reduce la movilización de las proteínas y las
grasas de los tejidos, por lo que también deprime muchas funciones
metabólicas.
La secreción insuficiente de mineralocorticoides provoca una falta de secreción de aldosterona reduciendo mucho la reabsorción de sodio por el túbulo renal,
permitiendo la pérdida de grandes cantidades de agua y de iones sodio y
cloruro por la orina. Como el líquido extracelular se reduce, el
volumen plasmático disminuye, la concentración de eritrocitos aumenta y
el gasto cardíaco se reduce.
Otra de las características de esta enfermedad es la coloración
característica de la piel que da un aspecto ceniciento o amarillo
parduzco, por estímulo de los melanocitos
causado por una gran secreción de ACTH como consecuencia de una
retroalimentación inadecuada debido a la disminución de cortisol.
Los pacientes deben recibir tratamiento con corticoides o fallecen al
cabo de unos pocos días debido al desequilibrio electrolítico grave y a
la deshidratación, casi siempre con un cuadro de shock circulatorio.
Sin embargo, estas personas podrán vivir durante muchos años si se le
administran pequeñas cantidades diarias de mineralocorticoides y
glucocorticoides.
Síndrome de Cushing
El exceso de corticosteroides da lugar a este síndrome, puede deberseprincipalmente a la presencia de un tumor en la corteza suprarrenal o a
un tratamiento farmacológico prolongado con corticoides. En caso de que
la causa sea por hipersecreción de ACTH por parte de la hipófisis anterior entonces se le llamará Enfermedad de Cushing.
El Síndrome de Cushing se caracteriza por alteraciones del
metabolismo de los hidratos de carbono y las proteínas, hipertensión y
debilidad muscular. Las alteraciones metabólicas le dan al cuerpo un
aspecto hinchado y también pueden inducir modificaciones estructurales
como las denominadas “joroba de búfalo” por movilización de la grasa de
la parte inferior del cuerpo y su depósito simultáneo en las regiones
torácicas y superior del abdomen, y “cara de luna” debida a edema
facial. La potencia andrógena de algunas hormonas puede causar acné e hirsutismo
(exceso de crecimiento de vello facial). Como los glucocorticoides
ejercen un efecto sobre el catabolismos de las proteínas, las proteínas
tisulares, a excepción de las del hígado, experimentan un descenso, y
esa pérdida de las proteínas musculares se manifiesta por intensa
debilidad y la falta de síntesis proteica en los tejidos linfáticos
conlleva la supresión del sistema inmunitario haciendo que estos enfermos sean más susceptibles a las infecciones. En otros casos, el menor depósito de proteína en los huesos suele provocar una osteoporosis grave con la debilidad ósea consiguiente.
El tratamiento depende de la causa. Si es causado por el uso de
corticosteroides se debe disminuir lentamente la dosis del fármaco (si
es posible) bajo supervisión médica. Si no se puede dejar de tomar el
medicamento debido a la enfermedad, se debe vigilar con cuidado el
azúcar alto en la sangre, los niveles altos de colesterol y la densidad
ósea para prevenir la osteoporosis. Si el Síndrome de Cushing es causado
por un tumor hipofisario o suprarrenal
o un tumor que segregue corticotropina el tratamiento es la extirpación
quirúrgica del tumor seguida a veces de radiación y complementada con
terapia de reemplazo con hidrocortisona (cortisol) después de la cirugía que posiblemente se requiera continuar durante toda la vida.
Mecanismo de acción
Los glucocorticoides se unen a receptores nucleares, que modifican la expresión de genes de la célula diana.Los efectos inmunosupresores de los glucocorticoides se deben
principalmente a la disminución en la producción de interleucina 2 y al
bloqueo de la migración de macrófagos. Los glucococorticoides son útiles
para inhibir el rechazo de trasplantes
porque disminuyen la liberación de antígenos por parte del injerto e
intervienen en la sensibilización y formación de anticuerpos ante él. El
cortisol entra a la célula blanco por difusión y se une a su receptor,
uniéndose a sitios específicos en el ADN, produciendo un aumento en la
síntesis de ARN y de proteínas de acuerdo al tipo de célula blanco. Así,
las acciones fisiológicas de los glucocorticoides incluyen regulación
de la síntesis proteica, metabolismo de proteínas, carbohidratos,
lípidos y ácidos nucleicos.
Metabolismo de los carbohidratos: Los glucocorticoides
aumentan la glicemia actuando como un antagonista de la insulina y
suprimen la secreción de insulina. Así inhiben la captación de glucosa
por los tejidos periféricos y promueven la gluconeogénesis.
Metabolismo de las proteínas: Se produce un efecto catabólico con aumento de la destrucción proteica y excreción de nitrógeno.
Los glucocorticoides aumentan el glicógeno hepático y
promueven la gluconeogénesis, produciendo una movilización de los
aminoácidos glicogénicos que provienen de estructuras de soporte como
músculo, piel, hueso y tejido conectivo; inhiben también la síntesis de
proteína y la captación de aminoácidos.
Ácidos grasos: Los glucocorticoides regulan la movilización de ácidos grasos produciendo activación de la lipasa celular.
Los glucocorticoides tienen propiedades antiinflamatorias que están
probablemente relacionadas con sus acciones en el territorio
microvascular y también por efectos celulares. El cortisol mantiene la
respuesta vascular normal a factores vasocontrictores y se opone a los
aumentos de permeabilidad capilar característicos de las inflamaciones
agudas Induce además el aumento de los leucocitos polimorfonucleares,
produce desaparición de los eosinófilos circulantes y disminuye la
actividad de los linfocitos T. El cortisol por esta vía altera la
inmunidad celular y humoral. Además los glucocorticoides inhiben la
producción y/o la acción de mediadores locales de la inflamación como
linfokinas y prostaglandinas. El cortisol responde en minutos a una
variedad de estrés físico y psíquico (trauma, cirugía, ejercicio,
ansiedad, depresión). La hipoglicemia y la fiebre también son potentes
estímulos para la secreción de ACTH y, consecuentemente, de cortisol.
Transporte, metabolismo y excreción de corticoides
Fijación del cortisol
El cortisol se une con una globulina alfa circulante llamadatranscortina o globulina fijadora de corticosteroide (CBG).También se
une en menor cantidad con la albumina, por tanto la vida media del
cortisol en sangre es de unos 60 a 90 min. Los esteroides unidos no
tienen actividad fisiológica. Debido a esta unión con las proteínas
existe una pequeña proporción de cortisol libre en la orina. El cortisol
unido a proteínas funciona como reservorio circulante de la hormona que
mantiene un suministro de cortisol libre disponible para los tejidos.
Con concentraciones normales de cortisol plasmático (375nmol/L) existe
muy poco cortisol libre en el plasma, pero los sitios de unión en la CBG
se saturan cuando el cortisol rebasa los 20 microgramo/dL. Con
concentraciones plasmáticas más altas se registra un aumente en la unión
con la albumina, pero lo que más aumenta es la fracción libre. La CBG
se sintetiza en el hígado y aumenta por efecto del estrógeno, las
concentraciones de CBG aumentan con el embarazo y disminuyen cuando el
hígado se ve afectado como pasaría con la cirrosis, nefrosis, y mieloma
múltiple. Cuando la concentración de la globulina aumenta, se une mas
cortisol y al principio disminuye el cortisol libre. Estimula la
secreción de ACTH y se secreta mas cortisol hasta alcanzar un nuevo
equilibrio en el cual el cortisol unido se incrementa pero el libre
permanece normal. Ocurren cambios en sentido contrario cuando disminuye
la concentración de CBG. Esto explica porque las embarazadas tienen
concentraciones altas del cortisol total sin síntomas por exceso de
glucorticoides y por el contrario, porque algunos pacientes con nefrosis
tiene cifras bajas de cortisol plasmático total sin síntomas de
deficiencia glucocorticoide.
Metabolismo y excreción
El cortisol se metaboliza en el hígado que es el principal sitio decatabolismo de los glucocorticoides. La mayor parte del cortisol se
reduce a horticorstisol y luego a tetrahidrocortisol, el cual se conjuga
con ácido glucórico. El sistema de la transferasa de glucuronilo que
permite esta conversión también cataliza la formación de glucorónidos de
bilirrubina, así como varias hormonas o fármacos. Existe una inhibición
competitiva entre estos sustratos por el sistema enzimático. El hígado y
otros tejidos presentan la enzima 11β-hidroxiesteroide deshidrogenasa.
Estén al menos dos formas de esta enzima. El tipo I cataliza la
conversión de cortisol en cortisona con la reacción inversa, aunque
principalmente funciona como reductasa y forma cortisol a partir de
corticosterona. El tipo II cataliza casi en forma exclusiva la
conversión de una vía de cortisol en cortisona. La cortisona es un
glucocorticoide activo porque se convierte en cortisol y es bien
conocida por su uso frecuente en medicina.las glándulas suprarrenales no
secretan cantidades apreciables de este compuesto. De la cortisona que
produce el hígado, poca o ninguna llega a la circulación debido a que es
rápidamente reducida y conjugada para formar glucurónido de
tetrahidrocortisona.los derivados tetrahidroglucuronidos (“conjugados”)
de cortisol y corticosterona permanecen solubles y libres. Entran a la
circulación, donde no se unen con proteínas. Se excretan con rapidez en
la orina, en parte por secreción tubular. Cerca del 10% del cortisol
secretado es convertido en derivados 17-cetoesteroides de cortisol y
cortisona en le hígado. La mayor parte de los cetoesterosidos se
conjugan con sulfato y luego se excretan en la orina. Se forman otros
metabolitos, existe una circulación enterohepática de glucorticoides y
cerca del 15% del cortisol secretado se excreta en las heces. El
metabolismo de la corticosterona es similar al del cortisol, excepto en
que no se forma un derivado 17-cetoesteroide.
Variación en la velocidad del metabolismo hepático
La velocidad de la desactivación de los glucocorticoides disminuye enlas enfermedades hepáticas y durante intervenciones quirúrgicas y otras
situaciones de estrés, lo cual resulta interesante. Por tanto, en
humanos sometidos a estrés, la concentración plasmática de cortisol se
eleva más que con la estimulación máxima de ACTH en ausencia de estrés
Glucocorticoides sintéticos
Son utilizados como antiinflamatorios e inmunodepresoresLa dexametasona ( y sus derivados, la dexametasona fosfato sódico y la dexametasona acetato)
Se absorbe rápidamente por vía oral. Las máximas concentracionesplasmáticas se obtienen al cabo de 1-2 horas. La duración de la acción,
depende del modo de la inyección (intravenosa, intramuscular o
intraarticular) y de la irrigación venosa de la zona inyectada. Tras una
administración cutánea, el grado de absorción depende de la integridad
de ese; en este caso, aumenta en las zonas lesionados y es intensa en
los lugares donde el estrato córneo es delgado. Sin embargo, con una
administración oftálmica de dexametasona, sólo se produce una mínima
absorción sistémica.
En la circulación sistémica, la dexametasona se une débilmente a las
proteínas plasmáticas, siendo activa la porción no fijada a las
proteínas. El fármaco se distribuye rápidamente en los riñones,
intestinos, hígado, piel y músculos. cabe destacar, que los corticoides
pueden atravesar la placenta y se excretarse en la lecha materna. La
dexametasona es metabolizada en el hígado originando productos inactivos
que son eliminados en la orina (los cuales tardan en eliminarse entre
1.8 y 3.5 horas; biológicamente dura entre 36 y 54 horas)
Fludrocortisona
Es un corticosteroide, que se usa para ayudar a controlar la cantidadde sodio y los líquidos del cuerpo. Se usa para tratar la enfermedad de
Addison (aunque tiene una ala actividad de gluocorticoide) y los
síndromes donde se pierden cantidades excesivas de sodio en la orina.
También se usa para aumentar la presión arterial.
Prednisona
Se suele tomar por vía oral, pero puede ser administrado por víaintramuscular. Es usado para un gran número de afecciones. Proviene de
la prednisona es una prodroga que es convertida por el hígado en
prednisolona, la cual es la forma esteroide activa.
Triamcinolona
Suele usarse para reemplazar glucocorticoides que el organismo nopuede fabricar, o que no fabrica lo suficiente. Alivia la inflamación
(hinchazón, calor, enrojecimiento y dolor) y se usa para tratar ciertas
formas de artritis; enfermedades a la piel, sangre, riñón, ojos,
tiroides y trastornos intestinales (colitis); alergias severas; y asma.
Betametasona
Se usa para tratar el prurito (picazón), enrojecimiento, sequedad, laformación de costras, despellejamiento, inflamación y el malestar
provocados por diversas afecciones a la piel.
Bibliografía
- Arthur C. Guyton, M.D. & John E.Hall, Ph.D. 2006, "Tratado de fisiología médica", decimoprimera edición, ELSEVIER, 1115 pps.
- Ira Fox, Stuart, 2008, "Fisiología humana", décima edición, McGraw Hill, 775 pps
- F.Ganong 2004,"fisiología médica", 19 ª edición williamed.el manual moderno
- http://www.nlm.nih.gov/medlineplus/spanish/ency/article/000410.htm
- http://www.iqb.es/cbasicas/farma/farma04/d009.htm
- http://www.vademecum.es/principios-activos-ficha-h02aa02
- http://www.nlm.nih.gov/medlineplus/spanish/druginfo/meds/a682549-es.html
- http://www.nlm.nih.gov/medlineplus/spanish/druginfo/meds/a601122-es.html
- http://www.nlm.nih.gov/medlineplus/spanish/druginfo/meds/a682799-es.html



No hay comentarios:
Publicar un comentario